| BAŞLIKLAR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
| |
|
Elektroliz suyun elektrik yoluyla analiz (çözümleme) edilmesidir. Yani, suyun içinden elektrik geçirerek, su oksijen ve hidrojene ayrıştırılır. Sudan elektrik geçebilmesi için suyun içine asit damlatılması gerekir. Çünkü saf su iletken değildir.Sonra elektrotlar yardımıyla elektrik geçmesi sağlanır. Aşağıdaki resim ve şekilleri inceleyiniz.
|

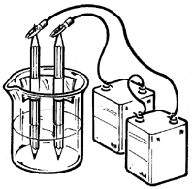
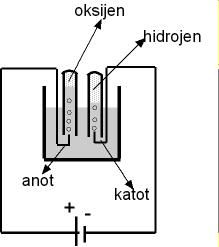
Şekil 1 bir elektroliz deneyinin fotoğrafıdır. Şekil 2 de basit bir resmi yapılmıştır. Şekil 3 elktroliz deneyinin sembolik gösterimidir.Elektroliz işleminde asitli suya iki iletken daldırılmış ve bu iletkenler üretece bağlanarak akım geçmesi sağlanmıştır.(Resimde iletken olarak kurşun kalemin grafit çubuğu kullanılmış). Sudan elektrik geçerken kurşun kalemlerin uçlarından kabarcıklar halinde hidrojen ve oksijen gazları çıkar. Bu gazları tutabilmek için deney tüpleri suya dolu olarak daldırılır. Böylece su (H2O) hidrojen ve oksijene ayrılmış olur. Aşağıda elektroliz ile ilgili tanımları bulacaksınız.
-
Elektrolit: Sulu çözeltisi elektriği ileten madde. Örneğin , Sülfirik asit (H2SO4), hidroklorik asit (HCl), nitrik asit (HNO3) çözeltileri.
-
Elektrot: Suya daldırılan iletkenler. Örneğin, grafit çubuk.
-
Anot: Üretecin artı kutbuna bağlana elektrot.
-
Katot: Üretecin eksi kutbuna bağlana elektrot.
-
Elektroliz kabı (voltametre): elektroliz işleminin yapıldığı kap.
Sudan belli bir miktar akım geçtiğinde, açığa çıkan hidrojen hacmi oksijenin iki katı olur. Çünkü su iki hidrojen bir oksijen atomundan oluşur. Anotta oksijen, katotda hidrojen birikir. Çünkü hidrojen iyonu (H+) artı yüklü, oksijen (O-2) eksi yüklü olduğundan, eksi elektrot artı yüklü iyonu çeker.
Not: Elektroliz kabından 1 C yük geçtiğinde, anotta 0,06 cm3 O2, katotta 0,12 cm3 H2 açığa çıkar.
|
|
|
|
|
|
| |
Bugün 4 ziyaretçi (59 klik) kişi burdaydı! |
|
|
|
|
|
|
|